Mikroben-WG
Was in und auf uns lebt, beschäftigt die noch junge Mikrobiomforschung. Das Team um Privatdozent Dr. Jan Kehrmann hat Erstaunliches entdeckt.
Von Jennifer Meina
Auf der Haut, den Schleimhäuten des Darms und der Lunge – überall tummeln und vermehren sie sich: rund 39 Billionen Bakterien. Eine unangenehme Vorstellung? Im Gegenteil! Sie sind lebenswichtig. Unsere winzigen Mitbewohner – Bakterien, Viren, Pilze, Parasiten –, die zusammen das sogenannte Mikrobiom bilden, haben einen riesigen Einfluss auf die Gesundheit und Erkrankungen.
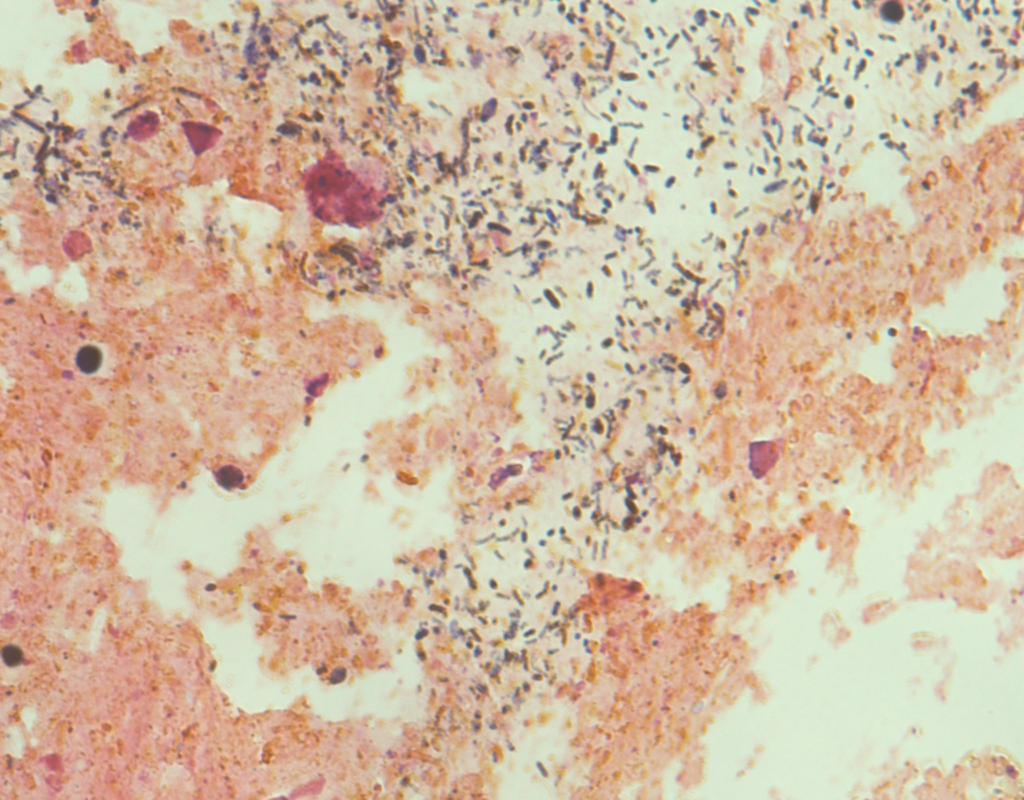
Was stellen die über 1.000 verschiedenen Bakterienarten auf, in und mit uns an? Welche Zusammensetzung hält uns gesund, welche macht uns krank? Und kann das Mikrobiom verändert werden und können dadurch Krankheiten verhindert oder geheilt werden? Privatdozent Dr. Jan Kehrmann vom Institut für Medizinische Mikrobiologie beschäftigt sich mit diesen Forschungsfragen. Im Fokus des Wissenschaftlers steht das Erbgut unserer Mikroben-WG. „Durch den Einsatz der Next-Generation-Sequencing-Technologie ist seit etwa 15 Jahren ein ganz neuer Blick auf die mikrobiellen Gemeinschaften möglich. Wir werden von viel mehr unterschiedlichen Bakterienbesiedelt als zuvor angenommen. Allerdings stehen wir noch recht am Anfang, die komplexen Zusammenhänge zu verstehen. Eines wird aber immer deutlicher: wie wichtig Mikroorganismen sind, damit wir gesund bleiben“, so der Oberarzt.
Ein besonderes Augenmerk legen die Forschenden auf den Darm, wo über 99 Prozent unserer Mikroorganismen leben. Bakterien machen hier nicht nur viele Nahrungsmittelbestandteile überhaupt für den Menschen nutzbar, sie sind auch an der Reifung von Immunzellen beteiligt. Durch Stoffwechselprodukte „kommunizieren“ sie sogar mit entfernten Organen. In Tiermodellen konnte bereits ein Zusammenhang zwischen psychischen Erkrankungen wie Depressionen und einem veränderten Darmmikrobiom hergestellt werden. Auch Übergewicht, Autoimmunerkrankungen wie Diabetes und Multiple Sklerose oder Allergien können im Tiermodell durch Veränderungen des Darmmikrobioms ausgelöst werden.
»Bakterien haben ihr schlechtes Image zu Unrecht.«
BEHANDLUNGEN DER ZUKUNFT
Kehrmann betont: „Bakterien haben ihr schlechtes Image zu Unrecht. Einige machen uns krank, aber die vielen verschiedenen Bakterien, die uns besiedeln, halten uns gesund.“ Je diverser das Mikrobiom ist, desto besser ist anscheinend seine Funktionalität. Nur wie? Darauf Antworten zu finden, ist das Hauptziel der Forschung. Eine aktuelle Studie von Kehrmann und seinen Kolleg:innen hat gezeigt: Wer an SARS-CoV-2 erkrankt ist, hat eine weniger vielfältige Darmflora – es häufen sich Bakterien, die mit verschiedenen entzündlichen Erkrankungen in Verbindung stehen, und gleichzeitig sind bei schweren COVID-19-Verläufen weniger entzündungshemmende Bakterien in der Darmflora zu finden*. Was bedeutet das? „Es zeigt sich, dass gesunde Menschen eine deutlich andere Darmflora haben als Kranke. Bei schweren COVID-19-Verläufen beobachten wir eine über- schießende Immunantwort mit erhöhten entzündungsfördern- den Zytokinen und Veränderungen von Immunzellen im Blut. Inwiefern das Darmmikrobiom des Menschen dafür ursächlich ist, ist aber noch unklar. Im Mausmodell konnte jedoch für andere virale Lungenerkrankungen wie z.B. Influenza bereits ein Zusammenhang zwischen Darmmikrobiom und Immunantwort der Lunge sowie Schwere des Krankheitsverlaufs nachgewiesen werden. Man spricht hier von der sogenannten ‚gut-lung axis‘.“ (etwa: Darm-Lungen-Achse).
Daneben vermuten die Forschenden, dass bestimmte Therapien abhängig vom Darmmikrobiom unterschiedlich wirkungsvoll sind. Dies könnte in Zukunft dazu führen, dass die Analyse der Darmmitbewohner – die dortige Suche nach bestimmten Biomarkern – genauso eine Standarduntersuchung wird wie Blutuntersuchungen. „Mediziner:innen könnten anhand der Ergebnisse Hinweise erhalten, wer einen schweren Krankheitsverlauf entwickelt oder wer schlechter auf bestimmte Therapien anspricht.“
MECHANISMEN VERSTEHEN
Letzteres ist auch Thema der Forschungsarbeit, die Kehrmanns Team derzeit mit Dermatolog:innen des UK Essen durchführt. „Wir haben herausgefunden, dass sich das Hautmikrobiom unter der Therapie der aktinischen Keratose – einer Vorstufe des hellen Hautkrebses – verändert und auch das Therapieansprechen abhängig von der Zusammensetzung des Hautmikrobioms unterschiedlich ist.“ Bei Patient:innen mit nur wenigen Corynebakterien im Mikrobiom ist die Therapie weniger effektiv, die Erkrankung schreitet voran. Wichtig für die Zukunft ist nun herauszufinden, ob die Bakterien dafür ursächlich sind – und durch welche Mechanismen das Hautmikrobiom das Zellwachstum beeinflusst. Je nach Ergebnis könnte es dazu führen, dass man das Hautmikrobiom gezielt verändert oder fehlende bakterielle Stoffwechselprodukte vor oder während der Therapie zusetzt, um ein höheres Ansprechen zu erreichen. Das ist aber noch Zukunftsmusik.
„Behandlungen von Erkrankungen durch Wiederherstellung eines gesunden Mikrobioms sind noch die Ausnahme. Durchfallerkrankungen durch Clostridioides difficile, die nach Antibiotikatherapien auftreten, werden aber seit mehreren Jahren erfolgreich durch Stuhltransplantationen behandelt.“ Der Mikrobiologe ist sich deshalb sicher: Viele Antworten auf medizinische Fragen seien sehr wahrscheinlich in der winzigen Welt des Mikrobioms zu finden. Gleichzeitig warnt Kehrmann aber auch vor einer allzu großen Erwartungshaltung: „Es gibt riesige Erwartungen an die Mikrobiomforschung und hunderte Studien, bei denen Stuhltransplantationen durchgeführt werden, um Krankheitsverläufe zu verbessern. Nicht alle werden die Erwartungen erfüllen können, und viele werden enttäuschend sein.“ Veränderungen des Mikrobioms werden sicherlich nicht immer erfolgreich Erkrankungen heilen können. Denn ein Mensch ist keine Maus – Ergebnisse aus tierexperimentellen Studien können nicht eins zu eins auf den Menschen übertragen werden.
Ein wichtiger nächster Schritt ist deshalb, die Mechanismen zu verstehen, wie das Mikrobiom die Erkrankung oder Genesung beeinflusst – oder wie die Erkrankung wiederum das Mikrobiom beeinflusst.
* Für die Studie wurden 212 Patient:innen untersucht, davon 117 mit einer SARS-CoV-2-Infektion und 95 negativ getestete Personen, die sich wegen anderer Beschwerden in der Universitätsmedizin Essen vorgestellt hatten.

MEILENSTEINE DER MIKROBIOM-FORSCHUNG:
Die Next-Generation-Sequencing-Technologie ermöglicht seit 2005 eine schnelle Analyse des menschlichen Darmmikrobioms. Zuvor mussten die Bakterien erst angezüchtet werden – was durch die teils anspruchsvollen Anforderungen an den Lebensraum bestimmter Arten kaum möglich war. Heute werden die Bakterien mithilfe der DNA-Sequenzierung einfach und schnell spezifiziert. Dieser technische Fortschritt ermöglichte es den Wissenschaftler:innen, nicht nur die Vielfalt der Billionen Organismen zu entdecken, sondern auch zu erforschen, wie eng unsere Gesundheit mit ihnen verknüpft ist.
Titelbild: © Jan Kehrmann